Table of Contents
Die Netzhaut
Die Verarbeitung des Lichtsignals findet bereits zu einem überraschend großen Teil in der Netzhaut und nicht erst im Gehirn statt. Das ermöglicht uns bereits viel aus der Untersuchung der Netzhaut über das Sehvermögen von Reptilien zu lernen. Die Netzhaut teilt sich unter dem Mikroskop in klar trennbare Schichten abwechselnd heller (zellkernarmer) und dunkler (zellkernreicher) Färbung. Das Licht wird dabei erst in der hintersten Schicht absorbiert. Dieser Aufbau in der “falschen Reihenfolge” ist evolutionär durch Korrekturmechanismen, beispielsweise Wellenleitereffekte [757Guck, J. (2012). Lebendige optik. Physik Journal, 6, 39–45.], optimiert.
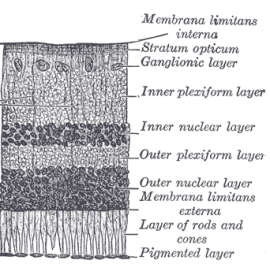
Quelle: Henry Gray's Anatomy of the Human Body, 1918; via Wikimedia Commons
Die Schichten in der Reihenfolge des Lichtwegs sind:
- Ganglienzellschicht (GCL - ganglion cell layer)
- Innere plexiforme Schicht (IPL - inner plexiform layer)
- Innere Körnerschicht (INL - inner nuclear layer), dunkel gefärbt
- Äußere plexiforme Schicht (OPL - outer plexiform layer)
- Äußere Körnerschicht (ONL - outer nuclear layer), dunkel gefärbt
- Photorezeptorschicht (IS, OS, RPE)
Bevor das Licht zu den Photorezeptoren gelangt, muss es mehrere Schichten Zellen durchdringen. Dies ist nötig, damit die Photorezeptorschicht von der Rückseite aus optimal versorgt werden kann.
Die Signalverarbeitung geschieht in der umgekehrten Reihenfolge.
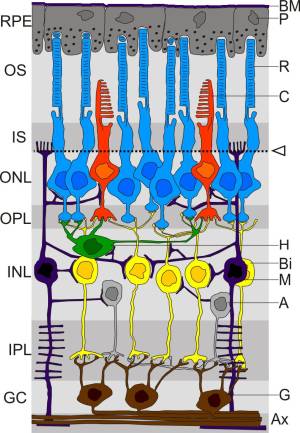
- Photorezeptor-Schicht (OS,IS), Äußere Körnerschicht (ONL)
Das Licht wird je nach Wellenlänge von verschiedenen Photorezeptoren absorbiert. Grundsätzlich werden dabei zwei Typen von Photorezeptoren unterschieden: Stäbchen (R) und Zapfen (C)
Bei Dunkelheit schütten die Photorezeptoren den Neurotransmitter Glutamat aus. Fällt Licht auf den Photoreptor hyperpolarisiert (Spannungserhöhung bei Wirbeltieren im Gegensatz zur Depolarisation bei z.B. Insekten) dieser, und stoppt die Freisetzung von Glutamat.
Glutamat ist der Neurotransmitter der zur Signalübertragung bis zu den Ganglienzellen (G) verwendet wird.
In der äußeren Körnerschicht befinden sich die Zellkerne der Photorezeptoren. - Äußere plexiforme Schicht (OPL)
In dieser Schicht findet die Verbindung zwischen den Photorezeptoren und den Zellen der nächsten Schicht statt. - Innere Körnerschicht (INL)
In der inneren Körnerschicht befinden sich die Zellkerne von Bipolarzellen (Bi), Amakrinzellen (A) und Horizontalzellen (H)- Bipolarzellen verbinden Photorezeptoren mit Ganglienzellen der nachfolgenden Schicht. Es gibt dabei zwei verschiedene Typen: ON-Bipolarzellen und OFF-Bipolarzellen. ON-Bipolarzellen schicken ein Signal, wenn der Photorezeptor Licht empfängt, OFF-Bipolarzellen schicken ein Signal, wenn der Photorezeptor kein Licht empfängt.
- Horizontalzellen erfüllen zwei Aufgaben:
Sie verbinden mehrere Photorezeptoren mit den Ganglienzellen der nächsten Schicht, und fügen so der eher punktförmigen Information der Bipolarzellen die Information über die Umgebung hinzu.
Außerdem geben sie Rückmeldung an die Photorezeptoren und helfen so beim Ausbalancieren des Signals, beispielsweise bei verschiedenen Helligkeitssituationen. - Amakrinzellen verbinden, ähnlich wie Horizontalzellen, Bipolarzellen auf einer horizontalen Ebene und übernehmen sehr spezialisierte Aufgaben.
- Innere plexiforme Schicht (OPL)
In dieser Schicht findet die Verbindung von den Bipolarzellen zu den Ganglienzellen statt. - Ganglienzellenschicht (GCL)
Die Ganglienzellen (G) verarbeiten die Signale der Bipolarzellen und Horizontalzellen. Sie empfangen dabei Signale aus einem rezeptivem Feld das einem kreisförmigem Gebiet auf der Netzhaut entspricht und unterscheiden zwischen dem Zentrum und dem Randbereich dieses Gebiets.
ON-center Ganglienzellen geben ein Signal, wenn das Zentrum ihres rezeptiven Felds gereizt wird, der Randbereich jedoch nicht;
OFF-center Ganglienzellen geben ein Signal, wenn der Randbereich ihres rezeptiven Felds gereizt wird, das Zentrum jedoch nicht. Die Unterscheidung “ON” (Signal im Zentrum des rezeptiven Felds) und “OFF” (Signal im Randbereich des rezeptiven Felds) bezieht sich nicht nur auf eine hell/dunkel-Information (ON-center: “heller Gegenstand vor dunklem Hintergrund”; OFF-center: “dunkler Text vor hellem Hintergrund ”), sondern auch auf Farbdifferenzen. Beim Menschen, mit den drei Zapfentypen rot, grün, blau, werden die Farbdifferenzen rot-grün und gelb-blau (wobei gelb die Summe aus rotem und grünem Signal ist) gebildet.
An das Gehirn wird also nicht das rot-grün-blau (RGB) Signal der Zapfen, sondern das gelb/blau - rot/grün - hell/dunkel (YCbCr) Signal der Bipolar- und Ganglienzellen gesendet.
Besonderheiten bei Reptilien
Die Netzhaut der Schmuckschildkröte ist in ihrem Aufbau zentriert auf einen Streifen hoher Zapfendichte (“visual streak”). Während die Zapfendichte im Randbereich der Netzhaut etwa 10000 Zellen pro mm² beträgt sind im visual streak vier mal so viele Zellen zu finden [2Ammermüller, J., & Kolb, H. (1996). Functional architecture of the turtle retina. Progress in Retinal and Eye Research, 15(2), 393–433.]. Der Bereich in dem Schmuckschildköten mit hoher Auflösung scharf sehen können ist kein kleiner Kreis sondern ein ausgedehnter horizontaler Streifen. Dieser dient mit seiner starken lateralen Vernetzung auch der Wahrnehmung von Beutegreifern. Eine Fotografie der Netzhaut des Menschen und der Schildkröte befindet sich in [47Kolb, H. (2003). How the retina works. American Scientist, 91, 28–35.]. Die unterschiedlichen Zapfentypen sind im Lichtmikroskop anhand ihrer farbigen Öltröpfchen gut zu unterschieden [46Kolb, H., & Jones, J. (1987). The distinction by light and electron microscopy of two types of cone containing colorless oil droplets in the retina of the turtle. Vision Research, 27(9), 1445–1458.].
Die meisten Echsen besitzen als tagaktive Tiere eine reine Zapfenretina mit einer Fovea (Sehgrube) im Zentrum der Netzhaut. Bei Chamäleons [12Bowmaker, J. K., & Loew, E. R. (2005). The cone photoreceptors and visual pigments of chameleons. Journal of Comparative Physiology A, 191(10), 925–932.], Leguanen und Agamen ist die Fovea in der Regel tiefe Sehgrube, während sie bei Eidechen, Skinten und Varanen flach ist. Anolis sind in dieser Hinsicht unter den Reptilien einzigartig, da sie zwei Sehgruben besitzen, eine zentrale tiefe Sehgrube und eine seitliche flache Sehgrube. [270Röll, B. (2001). Gecko vision—retinal organization, foveae and implications for binocular vision. Vision Research, 41(16), 2043–2056.]
Strumpfbandnattern besitzen kein ausgeprägtes Zentrum hoher Zapfendichte im Auge, das hoch aufgelöstes Sehen ermöglicht. Jedoch ist die Zapfendichte ausreichend um den Sehsinn bei der Jagd einzusetzen und auf die Augen ihrer Gegner zu zielen [139Sillman, A. J., Govardovskii, V. I., Röhlich, P., Southard, J. . A., & Loew, E. R. (1997). The photoreceptors and visual pigments of the garter snake (thamnophis sirtalis): A microspectrophotometric, scanning electron microscopic and immunocytochemical study. Journal of Comparative Physiology A, 181(2), 89–101.]
Literatur
[757] Guck, J. (2012). Lebendige optik. Physik Journal, 6, 39–45.
[2] Ammermüller, J., & Kolb, H. (1996). Functional architecture of the turtle retina. Progress in Retinal and Eye Research, 15(2), 393–433.
[47] Kolb, H. (2003). How the retina works. American Scientist, 91, 28–35.
[46] Kolb, H., & Jones, J. (1987). The distinction by light and electron microscopy of two types of cone containing colorless oil droplets in the retina of the turtle. Vision Research, 27(9), 1445–1458.
[12] Bowmaker, J. K., & Loew, E. R. (2005). The cone photoreceptors and visual pigments of chameleons. Journal of Comparative Physiology A, 191(10), 925–932.
[270] Röll, B. (2001). Gecko vision—retinal organization, foveae and implications for binocular vision. Vision Research, 41(16), 2043–2056.
[139] Sillman, A. J., Govardovskii, V. I., Röhlich, P., Southard, J. . A., & Loew, E. R. (1997). The photoreceptors and visual pigments of the garter snake (thamnophis sirtalis): A microspectrophotometric, scanning electron microscopic and immunocytochemical study. Journal of Comparative Physiology A, 181(2), 89–101.
Discussion