Table of Contents
Flickersehen
Alle Lampen flackern zu einem gewissen Grad und das kann Auswirkungen auf das Wohlbefinden und die Gesundheit haben.
Ursachen des Flackern von Lampen und Messgrößen
In Europa werden Lampen mit 50 Hz Wechselspannung versorgt. Es gibt mit doppelter Frequenz (100 Hz) Maxima der höchsten Stromstärke. Daher flackern grundsätzlich alle Lampen mit 100 Hz. Bei den alten Glüh- und Halogenlampen wird der Wolframdraht mit einer Frenquenz von 100 Hz durch den stärker und schwächer werdenden elektrischen Strom etwas heißer und kühlt wieder ab. Das übersetzt sich in Helligkeitsänderungen: Glüh- und Halogenlampen flackern mit 100 Hz und ca. 6-10 % Modulationstiefe. Bei alten Leuchtstofflampen mit konventionellem Vorschaltgeräten und LEDs mit sehr schlechter Vorschaltelektronik ist der Einbruch der Lichtintensität noch deutlich stärker. Andere Lampen nutzen elektronische Vorschaltgeräte oder Treiber um die Netzfrequenz mit einer höheren Frequenz zu überlagern und weiter zu glätten.
Modulationstiefe / Prozent Flicker
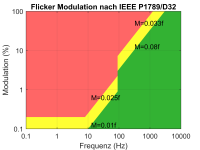
Bei einem sinusförmigen Flackern von Glühlampen mit der Intensität $I(t) = I_0 (1 + M\cdot sin(2\pi\cdot f \cdot t)) = I_0 (1 + M\cdot sin(t/T))$ ist $M$ die Modulationstiefe, z.B. 9%, und $f=100Hz$ die Frequenz bzw $T=10ms$ die Periodenlänge. Die Intensität schwankt zwischen (I0-MI0) und (I0+MI0). Die Modulationstiefe M wird auch als “Prozent Flicker” bezeichnet. Die Grenzwerte hierfür lauten [1400Ieee draft recommended practices of modulating current in high brightness leds for mitigating health risks to viewers. (2014). IEEE P1789/D32, September 2014, 1–80.]:
$M \leq f \cdot 0.08 \frac{\%}{Hz}$ für 90 Hz < f < 1250 Hz
$M \leq f \cdot 0.025 \frac{\%}{Hz}$ für 8 Hz < f < 90 Hz
$M \leq f \cdot 0.02 \%$ für f < 8 Hz
Bei dieser Grenze geht man davon aus, dass kein negativer biologischer Effekt auf den Menschen besteht. Aber erst bei einem um einen Faktor 2,5 geringeren Wert gilt es als sicher, dass überhaupt kein Flicker mehr Wahrnehmbar ist (NOEL = no observable effect level).
Flicker-Index
Berechnet man das Verhältnis der Fläche oberhalb der mittleren Intensität zur Gesamtfläche ergibt das den Flicker Index. Je kleiner der Wert ist, desto besser. Der Wert sollte - zusätzlich zur obigen Regel - unter 0,1 bzw. 10% liegen. Bei der Sinusschwankung der Glühbirne entspricht der Flicker-Index direkt der Modulationstiefe/Pi: $= \frac{\int_0^{T/2} I_0\cdot{}M\cdot{}sin(t/T))}{I_0\cdot{}T/2} = \frac{M}{\pi} = $ 2.86% (bei M = 9% und f = 100 Hz). Bei Lampen mit einem unregelmäßigeren Zeitverlauf können Modulationstiefe und Flicker-Index stark von einander abweichen. Der Flicker-Index betrachtet stärker den tatsächlichen zeitlichen Helligkeitsverlauf.
SVM (stroboscopic visibility measure)
“short-term flicker indicator (perceptibility) light meter method
PstLM
[1407Lindén, J., & Dam-Hansen, C. (2023). flicker explained: guide to iec 61547 for the lighting industry. Lund University.]
IEC 61000-3-3, Limits – Limitation of voltage changes, voltage fluctuations and flicker in public low-voltage supply systems, for equipment with rated current ≤16 A per phase and not subject to conditional connection, Edition 2.0, 2008-06
Gesetzliche Vorgabe
Für LEDs schreibt die Ecodesign-EU-Richtlinie Pst LM ≤ 1,0 und SVM (Stroboskobeffekt) ≤ 0,4, der vom Hersteller angegebene Wert darf maximal um 10% überschritten werden.
Wahrnehmung des Flackern
Bei Menschen sind drei Hauptauswirkungen von Flackern bekannt:
- Bei Menschen mit einer Photosensitiven Epilepsie können durch niederfrequentes Flacker mit 3 - 70 Hz (am häufigsten 15 - 20 Hz) Anfälle ausgelöst werden.
- Bewegte Objekte scheinen unter einer flackernden Beleuchtung zu springen, rotierende Objekte können sogar völlig bewegungslos erscheinen. Dieser Stroboskop-Effekt kann zu gefährlichen Situationen beim Bedienen von Maschinen führen.
- Frequenzen bis 160/200 Hz werden von der menschlichen Retina wahrgenommen, auch wenn das Flackern oft nicht bewusst gesehen wird. Verschiedene Studien zeigen, dass Flackern die Konzentrationsfähigkeit beeinflussen und Kopfschmerzen verursachen können.
Bei Vögeln spielt das Flimmern von Leuchtstoffröhren in der Haltung eine große Rolle. Bei Vögeln ist bekannt, dass die visuelle Wahrnehmung der Tiere bei einer flackernden Beleuchtung leidet: Weibliche Vögel sind in der Partnerwahl weniger eindeutig wenn Röhren mit konventionellem anstelle von elektronischem Vorschaltgerät verwendet werden [146Evans, J. E., Cuthill, I. C., & Bennett, A. T. D. (2006). The effect of flicker from fluorescent lights on mate choice in captive birds. Animal Behaviour, 72(2), 393–400.]. Es wird vermutet, dass die Haltung unter einer flimmernden Beleuchtung für die Tiere stressig ist [147Maddocks, S. A., Goldsmith, A. R., & Cuthill, I. C. (2001). The influence of flicker rate on plasma corticosterone levels of european starlings, sturnus vulgaris. General and Comparative Endocrinology, 124(3), 315–320.].
Die Wahrnehmung einer schnellen Folge von Lichtsignalen hängt mit der Geschwindigkeit der Informationsverarbeitung in der Netzhaut zusammen. Lebewesen die darauf angewiesen sind schnelle Bewegungen wahrzunehmen haben üblicherweise eine höhere Flimmerverschmelzungsfrequenz. Die Flimmerverschmelzungsfrequenz (critical flicker fusion threshold, CFF) gibt an, ab welcher Frequenz eine Folge von Lichtblitzen nicht nicht mehr wahrgenommen werden kann. Beim Menschen beträgt sich je nach Lichtintensität 20 bis 80 Hz [40Hentschel, H.-J. (2001). Licht und beleuchtung: grundlagen und anwendungen der lichttechnik 5th ed. Hüthig.]. Deutlich höhere Flickerfusionsfrequenzen sind bei Insekten möglich, die Flickerfusionsfrequenz von Schmeißfliegen liegt bei 250 Hz1), Jagdvögel besitzen eine Flickerfusionsfrequenz von bis zu 150 Hz. Bei dieser Definition wird dem Auge ein hartes an-aus Signal geliefert. Unter moderateren Bedingungen verschmilzt eine Bewegung bereits wesentlich früher. Bei Super-8 Videoaufnahmen reichen bereits 18 Einzelbilder pro Sekunde um den Eindruck eines Bewegungsablaufs zu erwecken. Ein flüssiger Bewegungsablauf ergibt sich bei 20 bis 30 Hz.
Flimmerverschmelzungsfrequenz von Reptilien
Eine experimentell relativ einfache Methode, die Flimmerverschmelzungsfrequenz von Tieren zu untersuchen, stützt sich auf die Optomotorik. Setzt man ein Tier in einen rotierenden Zylinder so folgen die Augen unwillkürlich der Bewegung. Sobald die Rotation so schnell ist, dass das Tier hell und dunkel nicht mehr unterscheiden kann sondern als gleichmäßiges Grau wahrnimmt, hört diese Augenbewegung auf.
• Gecko (Sphaerodactylus, reine Stäbchenretina): CFF=25Hz [303Crozier, W. J., & Wolf, E. (1939). The flicker response contour for the gecko (rod retina). Journal of General Physiology, 22, 555–566.]
• Schmuckschildkröte: CFF=50Hz [305Crozier, W. J., Wolf, E., & Zerrahn-Wolf, G. (1939). The flicker response function for the turtle pseudemys. Journal of General Physiology, 22, 311–340.]
• Krötenechse (reine Zapfenretina): CFF=42Hz [304Crozier, W. J., & Wolf, E. (1941). The flicker response contour for phrynosoma (horned lizard; cone retina). Journal of General Physiology, 24(3), 317–324.]
• Anolis: CFF=42Hz, Tiere aus dunklen Habitaten hatten eine niedrigere Flimmerverschmelzungsfrequenz [301Jenssen, T. A., & Swenson, B. (1974). An ecological correlate of critical flicker-fusion frequencies for some anolis lizards. Vision Research, 14(10), 695–970.]
Wenn man die Netzhaut mit Lichtblitzen bestrahlt und das elektrische Signal des Sehnerves betrachtet, kann man die Flickerfusionsfrequenz experimentell ermitteln. Mit einem Elektroretinogramm kann das elektrische Signal an der Hornhaut abgegriffen werden, und kann somit am lebenden (betäubten) Tier durchgeführt werden, ohne dieses zu schädigen. Untersuchungen mit Elektroretinogramm liefern höhere Flimmerverschmelzungsfrequenzen als optomotorische Methoden [300Fleishman, L. J., Marshall, C. J., & Hertz, P. E. (1995). Comparative study of temporal response properties of the visual system of three species of anoline lizards. Copeia, 1995(2), 422–431.]:
Solche Untersuchungen wurden bei verschiedenen Reptilien und Amphibien durchgeführt:
• Mensch: CFF=70Hz [297Crevier, D. W., & Meister, M. (1998). Synchronous period-doubling in flicker vision of salamander and man. Journal of Neurophysiology, 79(4), 1869–1878.]
• Anolis: CFF=70Hz, es wurden kaum Unterschiede bei Tieren aus hellem oder dunklem Habitat beobachtet [300Fleishman, L. J., Marshall, C. J., & Hertz, P. E. (1995). Comparative study of temporal response properties of the visual system of three species of anoline lizards. Copeia, 1995(2), 422–431.]
Dann gibt es noch eine Reihe weiterer Experimente, die Rückschlüsse auf die Flimmerverschmelzungsfrequenz zulassen. Trotz begrenztem Farbraum, zweidimensionalem Bild und Zusammensetzung aus Einzelbildern sind Echsen in der Lage auf einen Videofilm ihrer Artgenossen mit den üblichem Territorialverhalten zu reagieren [145Ord, T. J., Peters, R. A., Evans, C. S., & Taylor, A. J. (2002). Digital video playback and visual communication in lizards. Animal Behaviour, 63, 879–890.]. Und Brückenechsen konnten darauf trainiert werden, zwischen Lichtblitzen der Frequenzen 3 Hz bis 45Hz und konstanter Beleuchtung zu unterscheiden. Sie konnten Lichtblitze der Frequenz 65Hz jedoch nicht von konstanter Beleuchtung unterschieden [296Woo, K. L., Hunt, M., Harper, D., Nelson, N. J., Daugherty, C. H., & Bell, B. D. (2009). Discrimination of flicker frequency rates in the reptile tuatara ( sphenodon ). Naturwissenschaften, 96(3), 415–419.]. Ihre Flimmerverschmelzungsfrequenz liegt daher unter 65Hz.
Literatur
[1400] Ieee draft recommended practices of modulating current in high brightness leds for mitigating health risks to viewers. (2014). IEEE P1789/D32, September 2014, 1–80.
[1407] Lindén, J., & Dam-Hansen, C. (2023). flicker explained: guide to iec 61547 for the lighting industry. Lund University.
[146] Evans, J. E., Cuthill, I. C., & Bennett, A. T. D. (2006). The effect of flicker from fluorescent lights on mate choice in captive birds. Animal Behaviour, 72(2), 393–400.
[147] Maddocks, S. A., Goldsmith, A. R., & Cuthill, I. C. (2001). The influence of flicker rate on plasma corticosterone levels of european starlings, sturnus vulgaris. General and Comparative Endocrinology, 124(3), 315–320.
[40] Hentschel, H.-J. (2001). Licht und beleuchtung: grundlagen und anwendungen der lichttechnik 5th ed. Hüthig.
[303] Crozier, W. J., & Wolf, E. (1939). The flicker response contour for the gecko (rod retina). Journal of General Physiology, 22, 555–566.
[305] Crozier, W. J., Wolf, E., & Zerrahn-Wolf, G. (1939). The flicker response function for the turtle pseudemys. Journal of General Physiology, 22, 311–340.
[304] Crozier, W. J., & Wolf, E. (1941). The flicker response contour for phrynosoma (horned lizard; cone retina). Journal of General Physiology, 24(3), 317–324.
[301] Jenssen, T. A., & Swenson, B. (1974). An ecological correlate of critical flicker-fusion frequencies for some anolis lizards. Vision Research, 14(10), 695–970.
[300] Fleishman, L. J., Marshall, C. J., & Hertz, P. E. (1995). Comparative study of temporal response properties of the visual system of three species of anoline lizards. Copeia, 1995(2), 422–431.
[297] Crevier, D. W., & Meister, M. (1998). Synchronous period-doubling in flicker vision of salamander and man. Journal of Neurophysiology, 79(4), 1869–1878.
[145] Ord, T. J., Peters, R. A., Evans, C. S., & Taylor, A. J. (2002). Digital video playback and visual communication in lizards. Animal Behaviour, 63, 879–890.
[296] Woo, K. L., Hunt, M., Harper, D., Nelson, N. J., Daugherty, C. H., & Bell, B. D. (2009). Discrimination of flicker frequency rates in the reptile tuatara ( sphenodon ). Naturwissenschaften, 96(3), 415–419.
Discussion