Table of Contents
UVB-Strahlung, Vitamin D3 und Erkrankungen des Knochenstoffwechsels
Bereits seit dem 16. Jahrhundert wusste man, dass die leider sehr häufige Krankheit Rachitis bei Kindern durch Lebertran geheilt oder vorgebeugt werden kann. 1918 bewies der deutsche Kinderarzt Kurt Huldschinsky, dass sich Rachitis durch Sonnenlicht heilen lässt. 1922 wurde dann in Lebertran das Vitamin D entdeckt. Während Rachitis heute in den Industrieländern kein Problem mehr ist, ist eine Knochenerweichung bei Reptilien durch Vitamin-D3-Mangel leider immer noch eine häufige Erkrankung. Vielleicht haben Reptilien einen besonders hohen Bedarf an Vitamin D3 bzw. UV-Strahlung, weil sie durch ihr Verhalten (Sonnenbaden) und die unbehaarte Haut viel Sonnenstrahlung ausgesetzt sind. Eine ausreichende UV-Bestrahlung mit geeigneten UV-Lampen oder – je nach Art – Supplementierung mit Vitamin-D3-Präparaten ist bei der Haltung von Reptilien daher sehr wichtig.
Bildung von Vitamin D3 durch UV-Strahlung
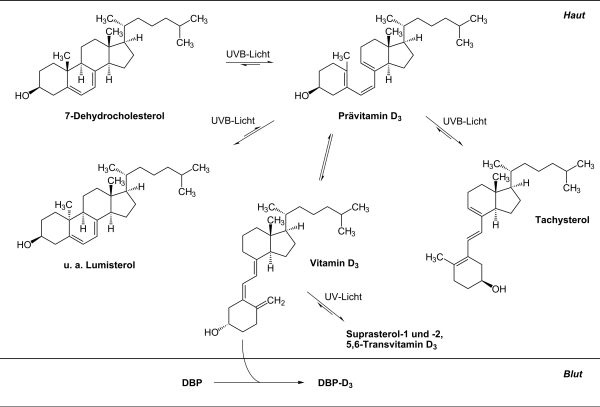
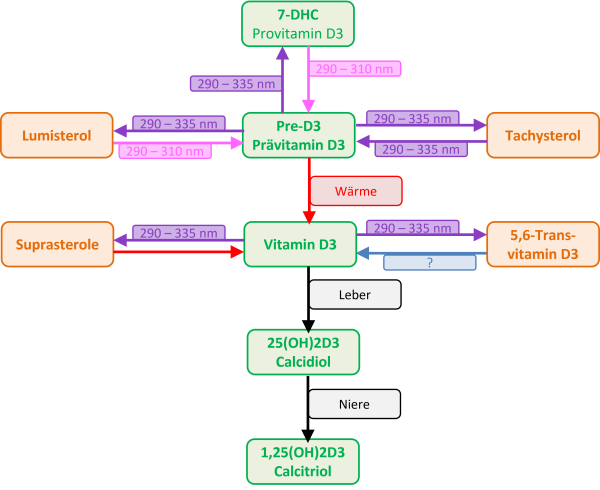
In der Haut von Wirbeltieren befindet sich das Sterin 7-Dehydrocholesterol (abgekürzt 7DHC, auch Provitamin D3 genannt) mit der Summenformel C27H44O. 7DHC kann ein UV-Photon mit einer Wellenlänge zwischen ca. 270 nm und 315 nm absorbieren und ändert dabei seine Molekülstruktur. Die Doppelbindungen ordnen sich neu an und der B-Ring öffnet sich. Das neue Molekül, Prävitamin D3, ist nicht stabil und wandelt sich selbstständig durch eine weitere Änderung der Molekülstruktur in Vitamin D3 um. Dieser Prozess benötigt Wärme, ist aber bei 20-35 °C sehr langsam. In menschlicher und tierischer Haut führen verschiedene Tricks, wie Nebenketten am 7DHC-Molekül, dazu, dass die Umwandlung in Vitamin D3 innerhalb weniger Stunden abläuft. Beim Menschen sind es etwa 8 Stunden. Reptilien und Amphibien mit niedriger Körpertemperatur haben diese Tricks so angepasst, dass die Umwandlung bei ihrer Aktivitätstemperatur mit der richtigen Geschwindigkeit abläuft. Kann sich ein Reptil aber nicht auf Solltemperatur aufwärmen, weil keine artgerechten Wärmequellen zur Verfügung stehen, kann kein oder nur wenig Vitamin D3 in der Haut gebildet werden.
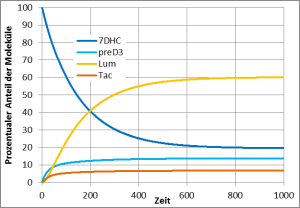
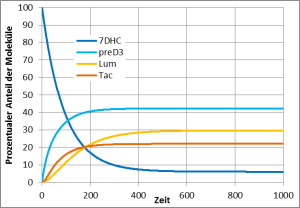
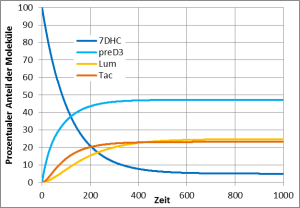
Solange das Prävitamin D3 noch nicht in Vitamin D3 umgewandelt ist, kann es aber ein weiteres UV-Photon absorbieren und sich entweder zurück in 7DHC umwandeln oder in eine der beiden Substanzen Lumisterol und Tachysterol. Auch Lumisterol und Tachysterol können ihrerseits nach Absorption eines UV-Photons wieder in Prävitamin D3 umgewandelt werden. In der Haut findet also eine Art Tanz statt, in dem jedes Molekül immer wieder zwischen den vier Erscheinungsformen 7DHC, Prävitamin D3, Lumisterol und Tachysterol wechselt und nur nach und nach, wenn es gerade in der Form Prävitamin D3 ist, in Vitamin D3 umgewandelt wird und damit diesen Tanz verlässt.
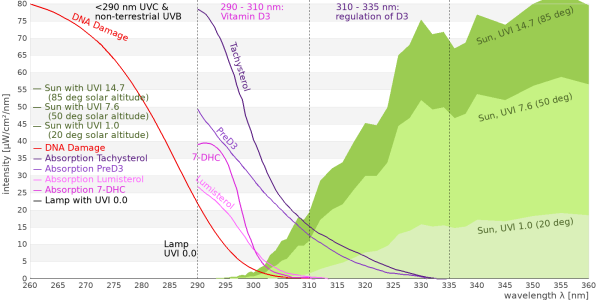
Dieses chemische Gleichgewicht zwischen 7DHC, Prävitamin D3, Lumisterol und Tachysterol wird in vielen einfacheren Darstellungen der Vitamin-D3-Bildung oft verschwiegen, aber es ist besonders wichtig. Denn während für die Umwandlung von 7DHC oder Lumisterol nach Prävitamin D3 ein UV-Photon mit einer relativ kurzen Wellenlänge (270 – 315 nm) notwendig ist, kann die Umwandlung von Prävitamin D3 nach 7DHC, Lumsterol oder Tachysterol auch durch ein Photon mit längeren Wellenlängen (270 – 335 nm) erfolgen. Das Sonnenlicht enthält sehr viel mehr UV-Photonen mit den längeren Wellenlängen, so dass bei natürlichem Sonnenlicht nur etwa 15-20 % des 7DHC in Prävitamin D3 umgewandelt werden und viel Lumisterol und etwas weniger Tachysterol gebildet werden. Bei einer künstlichen UV-Quelle mit weniger Intensität im längeren Wellenlängenbereich wird dieses Gleichgewicht ganz anders ausfallen. Bei einer Messung mit UV zwischen 295-300 nm Wellenlänge waren es 60 % und entsprechend nur 5-10% statt 50-60% Lumisterol.
Dieser Prozess findet hauptsächlich in den Zellen der Epidermis (Oberhaut) statt. Zwar befindet sich 7DHC auch in der darunter liegenden Dermis (Lederhaut), dorthin gelangt aber weniger UV-Strahlung. Das gebildete Vitamin D3 verlässt anschließend die Plasmamembran der Zellen in der Epidermis und diffundiert zu den Blutgefäßen in der Dermis. Dort bindet Vitamin D an ein spezielles Transportprotein und wird im Blut abtransportiert.
Solange das Vitamin D3 aber noch in der Epidermis ist, kann es durch weitere UV-Strahlung in verschiedene Supersterole, 5,6-Trans-VitaminD3 und Toxisterole umgewandelt werden. Alle diese Nebenprodukte wirken nicht auf den Kalziumspiegel und schützen so vor einer Vitamin-D3-Überdosierung. Es ist durch Sonnenlicht und Lampen mit einem ausreichend sonnenähnlichen Spektrum nicht möglich, Vitamin D3 überzudosieren. Gleichzeitig haben diese Nebenprodukte aber auch eine positive gesundheitliche Wirkung, beispielsweise schützt Lumisterol vor Hautkrebs.
Beim Versuch am Menschen mit Sonnenstudio UVB-Bestrahlung wurde ermittelt, dass eine Dosis von 1 MED äquivalent zur Einnahme von 10'000 IU bis 20'000 IU Vitamin D ist (Holick 2004). Da sich das Spektrum der Sonnenstrahlung ändert und zur Vitamin-D-Bildung in der menschlichen Haut eine Schwelle überschritten werden muss, kommt es bei klarem Himmel bereits ab 51° nördlicher Breite zu einem UV-Winter, währenddessen in menschlicher Haut kein Vitamin D gebildet werden kann. Bewölkung, Ozon und Smog können diesen Winter um mehrere Wochen bis Monate verlängern (Webb, Kline, & Holick 1988).
All das hier beschriebene und noch viel mehr Details können in dem frei zugänglichen sehr lesenswerten Artikel (Wacker & Holick 2013) nachgelesen werden, der auch einen schönen historischen Überblick gibt.
Vitamin D3 und der Knochenstoffwechsel
Vorweg möchte ich so ehrlich sein, anzumerken, dass das Thema dieses Abschnitts sehr weit in die Fachbereiche organische Chemie, Biochemie und Medizin eintaucht, und dort mein Fachwissen sehr gering ist. Ich fühle mich beim Schreiben ein bisschen wie bei Powerpoint-Karaoke. Ich freue mich daher einerseits besonders über Feedback und Korrektur. Andererseits warne ich darauf, meinen Aussagen zu sehr zu vertrauen.
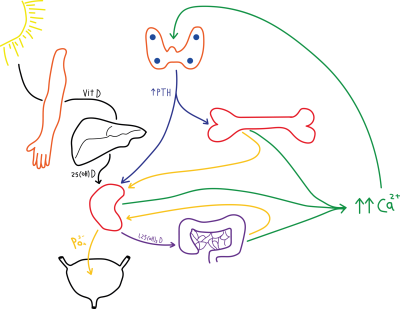
Sobald Vitamin D3 nach der Aufnahme über die Nahrung über den Verdauungstrakt oder der Bildung in der Haut durch UVB-Strahlung an Transportproteine gebunden ins Blut gelangt ist, wird es in den Mikrosomen der Leber innerhalb weniger Stunden mit Hilfe eines Enzyms in Calcidiol oder 25(OH)2D3 umgewandelt. Es wird wieder an ein Vitamin-D-bindendes Protein gebunden und gelangt zurück ins Blut. Calcidiol ist sehr stabil und wird nicht mehr durch UV-Strahlung zerstört (Hollis 2011). Calcidiol ist die „Speicherform“ von Vitamin D3 im Körper und hat eine Halbwertszeit von mehreren Monaten. Bei Blutuntersuchungen zur Vitamin-D3-Versorgung wird auf dieses Molekül getestet.
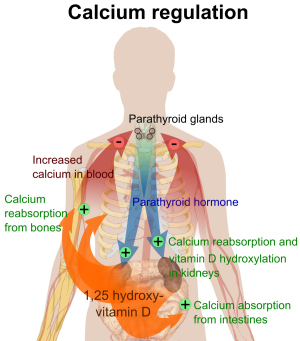
Wenn man darauf hofft (s.u.), dass Vitamin D3 selbst positiv auf den Körper wirkt, ist eine tägliche orale Zufuhr von Vitamin D3 oder eine UVB-Bestrahlung alle 2-3 Tage notwendig, da Vitamin D3 selbst nicht lange im Blut zirkuliert. Anschließend gelangt das Calcidiol an die Niere oder andere Organe, wo es in die aktive Form, Calcitriol umgewandelt wird. Diese Umwandlung ist sehr fein kontrolliert damit der Körper jederzeit einen optimalen Kalzium- und Phosphatspiegel hat. Die Bildung von Calcitriol wird durch einen erhöhten Parathormonspiegel (PTH, Nebenschilddrüsenhormon), verringerten Kalziumspiegel oder verringerten Phosphatspiegel im Blut ausgelöst. Über das Parathormon beeinflussen zusätzlich auch Östrogen, Glucocorticoide, Calcitonin, Somatotropin und Prolaktin die Bildung von Calcitriol. Calcitriol hat nur eine kurze Halbwertszeit von ca. 4 Stunden im Blut (Holick 2004). Die Blutspiegel schwanken sehr stark, so dass es sich für eine Gesundheitskontrolle nicht eignet.
Calcitriol bindet an verschiedenen Zielzellen an den Vitamin-D-Rezeptor (VDR), gelangt in den Zellkern und verändert dort die Transkription verschiedener Gene und damit die Proteinsynthese. Dadurch kommt die biologische Wirkung auf den Knochenstoffwechsel an vier Stellen zustande:
- Im Darm verbessert es die Aufnahme von Kalzium und Phosphat.
- Im Knochen findet fortwährend ein Auf- und Abbau des Knochengewebes statt. Der Auf- und Abbau wird durch Calcitriol, Parathormon, Calciumspiegel und Vitamin K beeinflusst.
- In der Nebenschilddrüse wird das Parathormon gebildet. Ein Mangel an Calcitriol führt zu einer vermehrten Bildung und Ausschüttung von Parathormon. Was wiederum sowohl auf den Knochenabbau als auch auf die Bildung von Calcitriol wirkt.
- In der Niere erhöht Calcitriol die Calciumreabsorption.
Es ist also bei weitem kein einfacher Zusammenhang, weswegen weiche Knochen nicht immer direkt etwas mit einem Vitamin-D3-Mangel zu tun haben, sondern auch mit Phosphor, Erkrankungen der Niere oder der Nebenschilddrüse etc. Es gibt mehrere Krankheiten, die unter dem Überbegriff „metabolic bone disase“ zusammen gefasst werden
Sekundärer Hyperparathyreoidismus (sHPT)
Beim Intestinalen Sekundären Hyperparathyreoidismus ist zu wenig Kalzium (oder Vitamin D3) in der Nahrung vorhanden. Beim Renalen Sekundärer Hyperparathyreoidismus ist die Niere aufgrund einer Erkrankung nicht in der Lage, Calcidiol in Calcitriol umzuwandeln, und so kann Kalzium aus der Nahrung nicht aufgenommen werden. Aufgrund des zu niedrigen Blutkalziumspiegels wird übermäßig Parathormon gebildet und Kalzium aus den Knochen ausgelöst. Eine Osteomalazie (oder Rachitis) ist die Folge.
fibröse Osteodystrophie
chronischer Kalzium und/oder Vitamin-D3 Mangel und/oder Kalzium:Phosphor-Ungleichgewicht führen dazu, dass Knochenmasse durch Bindegewebe ersetzt wird und die Knochen dadurch dick und aufgequollen sind.
Rachitis
Mangelnde Mineralisierung des Knochens in der Wachstumsphase von Jungtieren, geringe Knochenmasse, häufige Knochenbrüche. Verursacht durch Vitamin-D3-Mangel oder Kalzium-Mangel oder ungünstiges Kalium:Phosphor-Verhältnis. Bei der Behandlung von Rachitis durch die Gabe von Vitamin D3 ist es gar nicht das Calcitriol direkt, dass den Knochenaufbau fördert, sondern die vermehrte Aufnahme von Kalzium aus dem Darm und die Unterdrückung von Parathormon, was im Knochen zu einem vermehrten Aufbau führt (Dusso, Brown, & Slatopolsky 2005)
Osteomalazie
Der Knochenabbau findet bei Erwachsenen schneller statt als der Knochenaufbau, der Knochen wird weich. Verursacht durch Vitamin-D3-Mangel oder Kalzium-Mangel oder ungünstiges Kalium:Phosphor-Verhältnis.
Verkalkung des Gewebes
Eigentlich wirkt die Speicherform Calcidiol (25OHD) nicht auf den Kalziumstoffwechseln. Bei extrem hohem Blutspiegeln ist das aber nicht mehr der Fall. Dann wird direkt Kalzium und Phosphor aus den Knochen abgebaut und aus dem Darm entnommen. Eine Kalziumreiche Ernährung verschlimmert das Problem also. Der hohe Kalziumspiegel im Blut führt auch zu einer Schädigung der Niere, was den Phosphatspiegel weiter erhöht. Die Kalzium-Phosphor-Verbindungen lagern sich letztlich im Gewebe ab.
Bei einem grünen Leguan mit Verkalkung des Gewebes wurde jedoch gleichzeitig ein extrem geringer Vitamin-D3-Blutspiegel und kein erhöhter PTH-Spiegel festgestellt (Richman et al. ). So lange bei Reptilien also nicht gleichzeitig durch eine Blutprobe erhöhte Vitamin-D3-Werte festgestellt werden, darf man eine Verkalkung des Gewebes nicht als Beleg für eine Vitamin-D3-Überdosierung sehen. Eine mögliche Erklärung, warum ein Vitamin-D3-Mangel zu einer Verkalkung des Gewebes führt, beschreibt die Reptilientierärztin und UV-Lampen-Expertin Frances Baines (https://www.facebook.com/groups/ReptileLighting/posts/1950622581738995): Primäre Ursache ist eine chronische Niereninsuffizienz. Diese kann durch zu viel Protein in der Nahrung, zu warme und trockene Haltung, eine Infektion oder einen sekundären Hyperparathyreoidismus ausgelöst werden. Die insuffizienten Nieren filtern das Phosphat schlechter, so dass der Phosphor-Spiegel im Blut ansteigt. Da das Phosphor einen Komplex mit Kalzium bildet, sinkt der Kalziumspiegel. Die Nebenniere wird angeregt mehr Parathormon (PTH) zu bilden, was wiederum (s.o.) die Niere anregt, mehr Calcitriol zu bilden, um mehr Kalzium aus dem Darm aufzunehmen. Außerdem führt PTH zu einem stärkeren Knochenabbau. Die erkrankte Niere kann aber nicht ausreichend Calcitriol bilden, und damit gibt es auch keine Begrenzung der PTH-Bildung. Es wird fortwährend Kalzium und Phosphat aus den Knochen ausgebaut. Schließlich kommt es zum „Renalen Sekundären Hyperparathyreoidismus“. Die hohen Mengen an Phosphat im Blut bilden Komplexe mit dem Kalzium und lagern sich im Gewebe, besonders in den Nieren und um die Blutgefäße und das Herz ab.
Messung der Blutwerte bei Reptilien
Üblicherweise wird der “Speicherwert” des Vitamin D3, 25OHD, im Blut von Menschen und Reptilien bestimmt. Dazu gibt es verschiedene Methoden, die in den Laboren angewendet werden können. Leider liefern die verschiedenen Methoden zum Teil sehr deutlich unterschiedliche Blutwerte bereits beim Menschen. Bei Reptilien, die andere Vitamin-D3-bindende Proteine nutzen ist dieser Unterschied noch größer zu erwarten. Goldstandard ist die Massenspektrometrisch Methode (LC-MS/MS - liquid chromatography tandem mass spectrometry), die bei Reptilien ausschließlich angewendet werden sollte.
(Snellman et al. 2010) verglichen die PLC-APCI-MS ( high-pressure liquid chromatography-atmospheric pressure chemical ionization-mass spectrometry) mit der CLIA (chemiluminescence immunoassay) an menschlichen Blutproben und stellten fest, dass der CLIA deutlich kleinere Werte liefert (im Mittel CLIA 60nmol/L vs. HPLC 85nmol/L). (Heijboer et al. 2012) untersuchten Blutproben von 203 Menschen aus vier unterschiedlichen Gesundheitsgruppen mit 7 verschiedenen Labormethoden. Beispielsweise lag der Durchschnitt der Intensivstationspatienten bei der Methode “Elecysys” bei ca. 25 nmol/L, während er bei der Methode “Liaison” bei 50 nmol/L lag. Die Autoren schlussfolgern, dass es mit der Konzentration des Vitamin-D3-bindenden Proteins zusammenhängt. (Herrmann et al. 2010) entwickelten eine LC Tandem MS (liquid chromatography tandem mass spectrometry) Test (für die Humanmedizin). (Ong et al. 2017) weisen darauf hin, dass die häufig genutzte immunoassay-Methode anfällig dafür ist, durch Immunglobuline verfälscht zu werden: Bei einer Patientin mit Myelom wurden 327 nmol/L gemessen, mit LC-MS/MS-Test waren es nur 49 nmol/L. (Ouweland 2016)
(van den Ouweland, Vogeser, & Bächer 2013) gibt einen historischen Überblick über die Testmethoden und verweist ebenfalls auf die LC-MS/MS-Methode und die Unterschiede bei den Vitamin-D3-Metaboliten in verschiedenen Tieren. (Hurst, Homer, & Mellanby 2020) interpretiert die Situation im veterinärmedizinischen Kontext, empfiehlt nicht nur 25(OH)D zu messen und weist auf die LC-MS/MS-Methode als Goldstandard hin.
Folgen einer Vitamin-D3-Überdosierung
Beim Menschen wirkt eine Vitamin D Überdosierung in erster Linie toxisch, weil eine erhöhter Vitamin D Blutspiegel zu einem erhöhten Kalziumspiegel (aus der Nahrung oder den Knochen) im Blut führt. Eine Vitamin-D3-Überdosierung kann (insb. bei unzureichender Kalziumaufnahme aus der Nahrung) daher ebenfalls zu “weichen Knochen” führen ((Burt et al. 2019)) und mit einem Vitamin-D3-Mangel verwechselt werden.
Der erhöhte Blutkalziumspiegel wiederum schädigt die Nieren und führt langfristig dazu, dass sich Kalzium im Gewebe (Herz, Nieren, Lunge, Blutgefäße) ablagert. Zudem führt der erhöhte Kalziumspiegel im Blut zu Appetitlosigkeit, Übelkeit, Gewichtsverlust, Disorientiertheit. Es gibt außerdem Hinweise darauf, dass ein erhöhter Vitamin-D-Spiegel auch direkt verschieden Organe schädigt. Stark erhöhte Blutkalziumwerte mit Schädigung der Nieren (Nephrokalzinose) und ein vorrübergehender Wachstumsstillstand wurde bei Kleinkindern beobachtet, als es noch üblich war, den Kindern alle paar Monate eine hohe Dosis Vitamin D zu verabreichen (“Stoßtherapie”, 600'000 IU D2 alle 2 Monate) (Opinion of the Scientific Committee on Food on the Tolerable Upper Intake Level of Vitamin D 2002).
Bei Reptilien sind nur wenig Daten bekannt, ab wann mit einer Vitamin-D-Überdosierung zu rechnen ist. (Pallaske 1961) berichtet über einen grünen Leguan dem über einen längeren Zeitraum eine unbekannte, aber hohe Dosis (eigene Abschätzung mind. 400IU/kgKM/W) erhalten hat und plötzlich und mit deutlichen Organ- und Gefäßveränderungen starb. (Zwart ) berichtet über eine Gefäßwandverkalkung bei einem jungen grünen Leguan bei einer Vitamin D Dosis von 700IU/kgKM/W. Bei einer Köhlerschildkröte, die mit Katzenfutter gefüttert wurde, kam es zu Kalkablagerungen in den Organen (Barten 1982). Da in diesen Fällen aber nicht der Vitamin-D3-Blutspiegel überprüft wurde, ist unklar, ob hier wirklich eindeutig eine Vitamin-D3-Überdosierung vorliegt. Die Verkalkung kann auch andere Ursachen haben (s.o. verkalkung_des_gewebes). In einer Studie mit Waranen steig der Blutspiegel bei deutlich höheren Vitamin-D3-Gaben über das Futter (5000-15000 IU/kgKM/W) deutlich an (Ferguson et al. 2009). 432 IU/kgKM/W war bei Bartagamen nicht in der Lage gesunde Blutwerte zu erhalten (Oonincx et al. 2010). Damit ist fraglich, ob es sich hier wirklich um Vitamin D3 Überdosierung gehandelt hat.
Vitamin-D3-Aufnahme über die Nahrung
Grundsätzlich kann Vitamin D3 sowohl beim Menschen als auch bei Reptilien auch über die Nahrung gegeben werden. Vitamin-D-Supplemente für Menschen und Reptilen sind sowohl mit Vitamin D2 als auch Vitamin D3 erhältlich. Vitamin D2 wird von Pflanzen und Pilzen aus Ergosterol gebildet, Vitamin D3 wird von Tieren aus 7-Dehydrocholesterol gebildet. Es gibt Hinweise, dass Vitamin D3 vom Menschen besser aufgenommen wird als Vitamin D2. Wenn Vitamin D in ausreichender Menge über die Nahrung zugeführt werden kann, ist keine UVB-Beleuchtung notwendig. Beim Menschen liegt die nötige Menge in der Größenordnung 400 IU/Woche/kgKG (Heaney et al. 2003).
Für Reptilien gibt es keine übergreifenden Empfehlungen. Am Ende dieser Seite habe ich eine Tabelle mit allen mir bekannten wissenschaftlichen Veröffentlichungen zusammen gestellt, die zeigen, dass die Empfehlungen verschiedener Autoren sich sehr stark unterscheiden. Dazu kommt, dass es sicherlich auch Unterschiede im Bedarf bei verschiedenen Arten gibt. Es ist bereits bei Säugetieren bekannt, dass kleine Tiere bezogen auf das Körpergewicht eine höhere Dosis benötigen als große Tiere (einen Elefanten bringt man mit der Körpergewichtsbezogenen Dosis einer Maus um). Möglicherweise sind karnivore Reptilien auch eher in der Lage, Vitamin D3 über den Darm aufzunehmen als heliophile Pflanzenfresser. Und selbst wenn man eine konkrete Dosis wüsste, bei den vielen sehr kleinen Reptilien so geringe wöchentliche Mengen, dass es schwierig ist, diese exakt zu dosieren und dann auch sicher zu stellen, dass die Menge wirklich vom Reptil aufgenommen wird.
Positive Wirkung von Vitamin D3 über den Knochenstoffwechsel hinaus
Direkt nach der Entdeckung, dass Hauttuberkulose durch UV-Strahlung geheilt werden kann (Nobelpreis 1903) und der Entdeckung von Vitamin D3 gab es einen faszinierenden Hype um UV-Strahlung, der in einer sehr lesenswerten dreiteiligen Artikelserie von Albert & Ostheimer zusammengefasst ist (Albert & Ostheimer 2002). Nachdem auch die schädigende Wirkung von UV-Strahlung stärker erforscht war, schlug das Pendel in die andere Richtung. Seit den 1980ern gibt es wieder stärkere Forschung in der Humanmedizin welche positiven Aspekte Vitamin D3 über den Einfluss auf den Knochenstoffwechseln hinaus hat. Die meisten Zellen des menschlichen Körpers haben Rezeptoren für Vitamin D3. Bei einer Vielzahl von Krankheiten wie Krebs, Autoimmunerkrankungen, psychischen Erkrankungen, Herz-Kreislauferkrankungen und allgemeinen Problemen mit dem Immunsystem stellt man fest, dass Menschen, die wenig Sonnenstrahlung erhalten oder einen geringeren Vitamin D Blutspiegel haben, häufiger erkranken. Ob der Vitamin-D3-Mangel kausal für diese Erkrankungen ist oder nur korreliert ist in Studien leider oft unklar: Plakativ hat jemand der täglich nachmittags eine Stunde Joggen geht nicht nur einen höheren Vitamin-D3-Spiegel sondern ist auch gesünder, als der Computerspieler, der sein Haus nicht verlässt (natürlich werden diese Effekte in Studien herausgerechnet, perfekt klappt das aber nie). Und selbst wenn, ist damit nicht bewiesen, dass die Einnahme von Vitamin-D3 oder die UV-Bestrahlung zur Verbesserung der Gesundheit führt. Es wird in vielen Fällen auch vermutet, dass nicht der niedrige VItamin-D3-Spiegel zur Erkrankung führt (oder sie begünstigt), sondern die Erkrankung selbst den niedrigen Vitamin-D3-Spiegel verursacht. Es gibt aber auch Studien, die z.B. zeigen, dass eine am besten tägliche Einnahme von Vitamin D3 die Häufigkeit von Erkältungskrankheiten reduziert. Der oben bereits erwähnte frei zugängliche Artikel von Prof. Holick, (Wacker & Holick 2013), listet einige positive gesundheitliche Wirkungen von Vitamin D3 auf.
Viele Zellen des menschlichen Körpers haben Rezeptoren für Vitamin D bzw. können Vitamin D selbst mithilfe von zwei Enzymen in 25OHD und 1,25OHD umwandeln. Man geht davon aus, dass der Pfad über Leber und Niere wichtig für den Knochenstoffwechsel ist, die Umwandlung in den Zellen wichtig für die positive Wirkung von Vitamin D3 auf Autoimmunerkrankungen, Krebserkrankungen etc. (Hollis & Wagner 2013). In der Haut gebildetes oder über die Nahrung aufgenommenes Vitamin D3 gelangt über das Blut zu den Körperzellen und wird dort umgewandelt. Da Vitamin D im Blut keine lange Lebensdauer hat, da es instabil ist und sehr schnell von der Leber aufgenommen wird, ist für die Versorgung der Körperzellen mit Vitamin D3 eine regelmäßige Zufuhr von Vitamin D notwendig. Eine Gabe von Vitamin D über die Nahrung einmal in der Woche oder einmal im Monat oder eine wöchentliche Bestrahlung mit einer starken UV-Lampe sorgt zwar für hohe 25OHD-Blutspiegel und damit einen gesunden Knochenstoffwechsel, die Körperzellen erhalten aber nur wenig Vitamin D.
Einerseits habe ich den Eindruck, dass der weit verbreitete niedrige Vitamin-D3-Spiegel bei einem großen Teil der deutschen Bevölkerung kaum beachtet wird, obwohl er einfach und kostengünstig zu beheben wäre. Andererseits gibt es eine sehr aktive Gruppe im Pseudo-medizinischen nicht-evidenzbasierten Umfeld, die Vitamin D3 als Allheilmittel stilisieren und sehr hohe Vitamin-D3-Blutwerte anstreben. Die Wahrheit liegt wohl irgendwo in der Mitte. Für die Tierhaltung sollten wir meiner Ansicht nach naturnahe Blutwerte anstreben und dürfen sicherlich darauf hoffen, dass eine optimale Versorgung mit Vitamin D3 bzw. UVB nicht nur zur Verhinderung einer Rachitis, sondern auch allgemein für die Gesundheit unserer Pfleglinge förderlich ist.
Vergleich typischer Terrarienlampen mit dem natürlichen Sonnenlicht
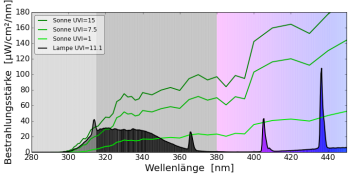
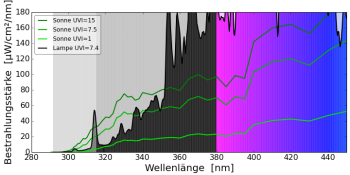
Ich möchte im Folgenden Spektren von verschiedenen UV-Lampen vergleichen: Wie beeinflusst das Lampenspektrum das Gleichgewicht bei der Vitamin-D3-Bildung? Die mathematischen Details für Interessierte verbergen sich hinter dem Button.
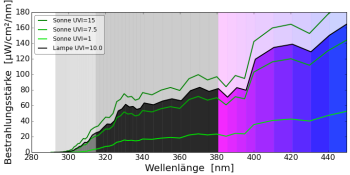
natürliches Sonnenlicht (60° Sonnenstand)
Natürliches Sonnenlicht wandelt 60% des 7DHC in Lumisterol, 5% in Tachysterol und 15% in PrävitaminD3 um. 20% des 7DHC bleiben erhalten. Dieser zeitliche Verlauf wurde so auch in Hautproben gemessen (Holick, MacLaughlin, & Doppelt 1981).
Aggressive Leuchtstofflampe mit Typ UVB313-Leuchtstoff
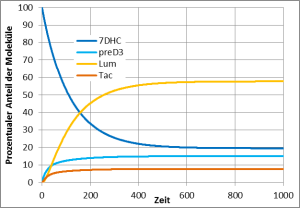
Leuchtstofflampen mit diesem wenig sonnenähnlichen Leuchtstoff tauchen leider immer wieder im Handel auf. Die Lampe strahlt UVB-Strahlung mit einer Wellenlänge kleiner als 300 nm in großer Intensität ab, die im natürlichen Sonnenlicht nicht vorkommt und sehr aggressiv ist. Solche Lampen verursachen einen starken Sonnenbrand.
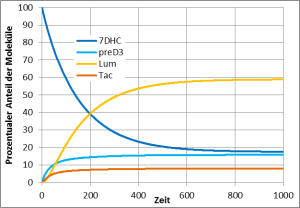
Auch auf das Vitamin-D3-Gleichgewicht wirkt diese Lampe unnatürlich: Während im natürlichen Sonnenlicht viel Lumisterol als Schutz vor UV-Schäden gebildet wird und nur recht wenig Prävitamin D3, wird bei dieser Lampe sehr viel Prävitamin D3 gebildet. Es besteht die Gefahr einer Vitamin-D3-Überdosierung!
Sonnenähnliche Leuchtstofflampe
Die Lampe mit sonnenähnlichem Spektrum wirkt auf das Vitamin-D3-Gleichgewicht fast genauso wie das natürlich Sonnenlicht.
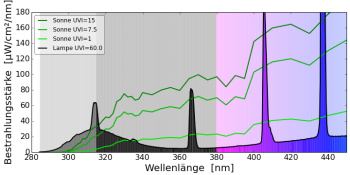
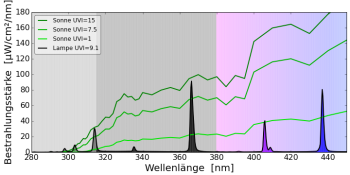
UV-Quecksilberdampflampe (Mischlichtlampe)
Die UV-Quecksilberdampflampe wirkt ähnlich unnatürlich wie die Typ UVB313-Leuchtstofflampe auf das Vitamin-D3-Gleichgewicht. Sie verursacht zwar keine schweren Verbrennungen, weil keine unnatürliche Strahlung mit einer Wellenlänge kleiner als 300 nm vorhanden ist, die Lücken im Spektrum zwischen 300 nm und 330 nm bewirken aber, dass sehr viel Prävitamin D3 gebildet wird. Auch bei diesen Lampen ist eine Überdosierung von Vitamin D3 möglich, bzw. es reicht bereits eine sehr kurze Bestrahlung aus, um viel Vitamin D3 zu bilden. Vielleicht eine Erklärung, warum die Osram Ultravitalux sich so sehr in der Rachitisbehandlung bewährt hat.
UV-Metallhalogeniddampflampe
Die UV-Metallhalogeniddampflampen haben im Gegensatz zur Quecksilberdampflampe weniger Lücken im Spektrum und sind im Bereich 310-330 nm besser aufgefüllten. Hier ist das Vitamin-D3-Gleichgewicht wieder ausgewogen und sehr ähnlich zum natürlichen Sonnenlicht.
Solarmeter-Verhältnis
Fast alle Absorptionsspektren der Moleküle, die bei der 25-OH-D-Bildung eine Rolle spielen lassen sich in zwei Gruppen einteilen: Absorption von UV-Strahlung mit einer Wellenlänge kleiner als 310 nm und Absorption von UV-Strahlung mit einer Wellenlänge kleiner als 335 nm. Auch das Solarmeter 6.2 und das Solarmeter 6.5 unterscheiden sich darin, dass eines auf Strahlung mit einer Wellenlänge kleiner 310 nm reagiert während das andere auch langwelligere Strahlung misst. Man kann mit dem Verhältnis zwischen Solarmeter 6.5 und Solarmeter 6.2 daher recht einfach abschätzen, ob die spektrale Verteilung einer UV-Lampe im Vitamin-D-Bereich sonnenähnlich ist oder nicht ( ⇒ verhaeltnis_von_solarmeter_62_und_solarmeter_65 )
Literatur
Holick, M. F., MacLaughlin, J., & Doppelt, S. (1981). Regulation of cutaneous previtamin d3 photosynthesis in man: Skin pigment is not an essential regulator. Science, 211(4482), 590–593.
Discussion